- Сформировать понятие о генетической связи и генетическом ряде.
- Рассмотреть генетические ряды металлов и неметаллов.
- Выяснить генетическую связь между классами неорганических соединений.
- Продолжить формировать умения пользоваться таблицей растворимости и периодической системой Д.И.Меделеева для прогнозирования возможных химических реакций, а также применять полученные знания по темам свойства классов веществ.
- Повторить основные классы неорганических соединений и их классификацию.
- Развивать познавательный интерес к предмету, умение быстро и четко отвечать на вопросы.
- Продолжать формировать умения логически мыслить, работать с учебником, работать с полученной информацией.
- Закрепить и систематизировать знания по данной теме.
Оборудование: Периодическая система Д.И. Менделеева, кодоскоп, таблица “Кислоты”, схема “Генетическая связь”, карточки для игры “Конвейер”, “Творческое задание”.
Реактивы: В штативах 3 пробирки с растворами HCI, NaCI, NaOH, универсальная индикаторная бумажка. На столе учителя: Na, H 2 O кристаллизаторе, фенолфталеин, H 2 SO 4 .
Класс разбит на 4 микрогруппы: “Оксиды”, “Кислоты”, “Соли”, “Основания”.
Ход урока
I. Организационный момент.
1. Дисциплина.
2. Готовность класса к уроку.
3. Постановка цели урока, мотивация.
II. Основная часть.
1. Целевая установка урока
Другого ничего в природе нет
Ни здесь, ни там в космических глубинах.
Все – от песчинок малых – до планет
Из элементов состоит единых.Как формула, как график трудовой,
Строй менделеевской системы строгой,
Вокруг тебя творится мир живой,
Входи в него руками трогай.
Сегодня мы собрались здесь, чтобы подвергнуть испытанию лучших восьмиклассников нашей школы и ответить на вопрос: “Достойны ли они, стать гражданами великой химической страны?” Страна эта древняя и волшебная, хранящая множество загадок. Отгадать многие из них еще не удавалось ни одному человеку. Лишь самым, умным, смелым и настойчивым эта страна приоткрывает свои тайны. Итак, начнем!
Итак, изучив тему “Важнейшие классы неорганических соединений” вы получили представление о том, что неорганические соединения многообразны и взаимосвязаны. На уроке мы с вами рассмотрим небольшие фрагменты взаимопревращений веществ, вспомним классификацию неорганических веществ, поговорим о единстве и многообразии химических веществ.
Задача нашего урока – обобщить сведения о веществах, об отдельных классах неорганических соединений и их классификации в целом, закрепить знания о генетических рядах, генетической связи, взаимодействии вещества разных классов, научиться умению применять знания на практике.
Запишите в тетрадях тему нашего урока “Генетическая связь между неорганическими соединениями”.
Но, сначала скажите о каких веществах идет речь (название, формула)?
- На суку сидит сова,
Выдыхает _____________________________ - Сапоги мои того,
Пропускают ___________________________ - Его все знают,
В магазине покупают,
Без него не сваришь ужин -
В малых дозах в блюдах нужен ___________ - Флакон с веществом, обычно имеется в каждой квартире,
С рожденья ребенок любой с ним знаком,
Едва лишь покинет он с мамой роддом,
Ею искупают в ванночке с _________ - Что за чудо посмотри,
По доске он проезжает,
За собой след оставляет. ____________________ - Если нет у вас для теста разрыхлителя
вы вместо него.
Положите в пироги. ________________________
Переведите с химического языка на
- Не все то аурум, что блестит.
- Куй феррум, пока горячо.
_____________________________________________________________ - Слово – аргентум, а молчание – аурум.
_____________________________________________________________ - 5.Купрумного гроша не стоит.
_____________________________________________________________ - Стойкий станумный солдатик.
_____________________________________________________________ - С тех пор много Н 2 О утекло.
_____________________________________________________________
Все эти вещества относятся, к какому то классу неорганических веществ. Ответьте на вопрос:
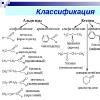
– Как распределяются по классам на основе состава и свойств неорганические
вещества?
– Назовите известные вам классы неорганических соединений
По микрогруппам:
– Дайте определения.
Ученики дают определения веществам.
– Классификация данных классов веществ.
Ученики дают ответы.
На слайде:
Из предложенного перечня неорганических соединений выберите формулы:
1 группа – оксиды,
2 группа – кислоты,
3 группа – соли.
4 группа – основания.
Назовите эти вещества.
Ученики выполняют задание в тетрадях по микрогруппам.

Правильный ответ:

А теперь поиграем с вами в игру “крестики – нолики”.
Слайд 19. Приложения 1.
Распределите вещества, формулы которых приведены в таблице по классам. Из букв, соответствующим правильным ответам, получите фамилию великого русского ученого
| Формулы | Оксиды | Кислоты | Основания | Соли |
| K 2 O | М | А | Ш | А |
| H 2 CO 3 | П | Е | Т | Р |
| P 2 O 5 | Н | И | М | А |
| CuSO 4 | П | О | С | Д |
| Ca(OH) 2 | Л | И | Е | С |
| Fe(NO 3) 3 | А | Н | У | Л |
| SO 2 | Е | Л | З | А |
| H 3 PO 4 | Н | Е | Л | С |
| Na 3 PO 4 | Ч | У | М | В |
Ответ: Менделеев.
Проблемное задание.
Могут ли разные классы неорганических соединений взаимодействовать друг с другом?
Выделить признаки генетического ряда:
Ca Ca(OH) 2 CaCO 3 CaO CaSO 4 CaCl 2 Ca ?
- вещества разных классов;
- разные вещества образованы одним химическим элементом;
- разные вещества одного химического элемента связаны взаимопревращениями.
Между классами существует важная связь, которую называют генетической ("генезиз" по-гречески обозначает "происхождение"). Эта связь заключается в том, что из веществ одного класса можно получить вещества других классов.
Генетическим называют ряд веществ – представителей разных классов неорганических соединений, являющихся соединениями одного и того же химического элемента, связанного взаимопревращениями и отражающего общность происхождения этих веществ.
Генетический ряд отражает взаимосвязь веществ разных классов, в основу которых положен один и тот же химический элемент.
Генетическая связь – связь между веществами разных классов, образованных одним химическим элементом, связанных взаимопревращениями и отражающая единство их происхождения.
Существует два основных пути генетических связей между веществами: один из
них начинается металлами, другой – неметаллами.
Среди металлов также можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щелочь. Этот ряд можно представить с помощью следующих превращений:
металл--основный оксид--щелочь–соль
Например: K--K 2 O--KOH--KCl.
2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл--основный оксид--соль--нерастворимое основание--основный оксид--металл.
Например: Cu--CuO--CuCl 2 --Cu(OH) 2 --CuO-->Cu
Среди неметаллов также можно выделить две разновидности рядов:
1
. Генетический ряд неметаллов, где в качестве звена ряда
выступает растворимая кислота.
Цепочку превращений можно представить в следующем виде:
неметалл--кислотный оксид--растворимая кислота--соль.
Например:
P--P 2 O 5 --H 3 PO 4 --Na 3 PO 4 .
2
. Генетический ряд неметаллов, где в качестве звена ряда
выступает нерастворимая кислота:
неметалл--кислотный оксид--соль--кислота--кислотный оксид–неметалл
Например: Si--SiO 2 --Na 2 SiO 3 --H 2 SiO 3 --SiO 2 --Si.

Осуществить превращения по микрогруппам.
Физкультминутка “Рыжий кот”.
Решение задачи.
Однажды Юх проводил эксперименты по измерению электропроводности растворов разных солей. На его лабораторном столе стояли химические стаканы с растворами KCl, BaCl 2 , K 2 CO 3 , Na 2 SO 4 и AgNO 3 . На каждом стакане была аккуратно приклеена этикетка. В лаборатории жил попугай, клетка которого запиралась не очень хорошо. Когда Юх, поглощенный экспериментом, оглянулся на подозрительный шорох, он с ужасом обнаружил, что попугай, грубо нарушая правила техники безопасности, пытается пить из стакана с раствором BaCl 2 . Зная, что все растворимые соли бария чрезвычайно ядовиты, Юх быстро схватил со стола стакан с другой этикеткой и насильно влил раствор в клюв попугаю. Попугай был спасен. Стакан с каким раствором был использован для спасения попугая?
BaCl 2 + Na 2 SO 4 = BaSO 4 (осадок) + 2NaCl (сульфат бария настолько малорастворим, что не способен быть ядовитым, как некоторые другие соли бария).
Демонстрационный эксперимент. Учитель показывает в пробирках образцы:
1 – кусочек кальция, 2 – негашеная известь, 3 – гашеная известь, 4 – гипс задает вопрос:
“Что общего между этими образцами?” и записывает цепочку из формул представленных образцов.
Ca CaO Ca(OH) 2 CaSO 4
Хорошо, ребята! Подумайте, как с помощью химических реакций можно перейти от простого вещества к сложному, от одного класса соединений к другим. Давайте проведем эксперимент, доказывающий присутствие атомов меди в разных ее соединениях. По ходу эксперимента запишите цепочку превращений. Назовите типы химических реакций.
Работа выполняется по инструктивной карте.
Соблюдайте правила техники безопасности!
Инструктивная карта.
Лабораторная работа: “Практическое осуществление цепочки химических превращений”.
Проверьте наличие оборудования и реактивов на рабочих местах.
Оборудование: штатив для пробирок, спиртовка, спички, зажим для пробирок, тигельные щипцы.
Реактивы и материалы: раствор соляной кислоты (1:2), медная проволока, железный гвоздь или скрепка, нитки.
Выполнение работы.
Проведите реакции, в которых осуществляются химические превращения.
Медная проволока оксид меди(II) хлорид меди(II) медь
Прокаливайте медную проволоку, удерживая ее тигельными щипцами, в верхней части пламени спиртовки (1–2мин). Что наблюдаете?
Аккуратно удалите черный налет с проволоки и поместите его в пробирку. Отметьте цвет вещества.
Прилейте в пробирку в пробирку 1 мл раствора соляной кислоты (1:2). Для ускорения реакции слегка нагрейте ее содержимое. Что наблюдаете?
Осторожно (почему?) погрузите в пробирку с раствором железный гвоздь (скрепку).
Через 2–3 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения.
Образованием какого вещества они вызваны?
Опишите и сравните цвет образовавшегося и исходного растворов.
Приведите рабочее место в порядок.
Внимание! Раствор с оксидом меди нагревать очень осторожно, держа пробирку высоко над пламенем спиртовки.

III. Заключение.
Учитель. Понятия “оксид”, “кислота”, “основание”, “соль” образуют систему, находящуюся в тесной взаимосвязи, она раскрывается при получении веществ одного класса из веществ другого класса. Она проявляется в процессе взаимодействия веществ и активно используется в практической деятельности человека. Как вы думаете, ребята, достигли мы цели, которую ставили в начале урока?
V. Домашнее задание.
Слайды 30, 31.
VI. Подведение итогов урока, оценивание, рефлексия.
Учитель. Ребята, пришло время подводить итоги. Чему вы сегодня научились, что узнали нового, что вы делали на уроке?
Ученики дают ответы.
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Целосность и разнообразие химических веществ наиболее выражено изображены в генетической связи веществ, которая раскрывается в генетических рядах. Рассмотрим самые важные признаки генетических рядов:

Генетические ряды – это группа органических соединений, у которых равное число атомов углерода в молекуле, различающихся функциональными группами.
Генетическая связь – более общее понятие, в отличие от генетического ряда, который пусть и является достаточно ярким, но в тоже время частным проявлением данной связи, которая может происходить при любых двусторонних превращениях веществ.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Генетические связи между классами неорганических соединений. Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакций
С веществ одного класса можно получить вещества другого класса. Такая связь между классами неорганических соединений называют генетическим. Рассмотрим его более подробно. Из простых веществ можно получить сложное вещество, например:
С сложного вещества можно получить простые вещества, например:
Из металла реакцией горения можно получить основной оксид, который с водой образует основу. При воздействии на основу кислотой реакцией нейтрализации можно получить соль. Рассмотрим такой генетическую связь на примере металла бария. Составим схему:
1) 2Ba + O2 = 2BaO
2) BaO + H2O = Ba (OH)2
3) 3Ba (OH) 2 + 2H3PO4 = Ba3 (PO4)2 ¯ + 6H2O
С неметалла реакцией горения можно получить кислотный оксид, который с водой образует кислоту. При действии на кислоту основой реакцией нейтрализации можно получить соль. Рассмотрим такой генетическую связь на примере неметалла фосфора. Составим схему:
Составим уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
1) 4P + 5O2 = 2P2O5
2) P2O5 + 3H2O = 2H3PO4
3) 2H3PO4 + 3Ba (OH)2 = Ba3 (PO4)2 ¯ + 6H2O
Приведенные выше схемы генетических связей можно представить в общем виде следующей схеме:
металл → основной оксид → основа →
соль
неметалл → кислотный оксид →
кислота
Рассмотрим примеры задач, связанных с расчетами по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакций.
Решение задач такого типа надо начинать с составления уравнения или нескольких уравнений тех реакций, о которых говорится в задаче. Расчеты можно проводить только по уравнению реакции, поэтому необходимо внимательно проверить все коэффициенты. Коэффициенты показывают не только число молекул исходных веществ и продуктов реакции, но и число моль веществ, участвующих в реакции. Имея такую информацию и зная массу, количество вещества (или в случае газов объем одного из веществ, реагирующих), можно определить число моль, массу (или в случае газов объем) любой другой вещества.
Задача № 1 . Определите массу гидроксида натрия, необходимое для полной нейтрализации 19,6 г серной кислоты.
Решение: Серная кислота H2SO4 является двух основных кислотой. Для полной нейтрализации одного моль этой кислоты необходимо два моль гидроксида натрия NaOH, что видно из уравнения химической реакции: H2SO4 + 2NaOH = Na2SO4 + 2 H2O
По известной массе серной кислоты определим количество вещества по формуле:![]()
Молярная масса серной кислоты равна:
M (H2SO4) = 2 · Ar (H) + Ar (S) + 4 · Ar (O) = 2 · 1 + 32 + 4 · 16 = 98
Количество вещества серной кислоты равна:
Коэффициент перед формулой гидроксида натрия в уравнении реакции в два раза больше коэффициента перед формулой серной кислоты, поэтому:
ν (NaOH) = 2 · ν (H2SO4) = 2 · 0,2 моль = 0,4 моль
Определим массу гидроксида натрия, который соответствует этому количеству вещества, по формуле: m = ν · M
Молярная масса гидроксида натрия равен:
M (NaOH) = Ar (Na) + Ar (O) + Ar (H) = 23 + 16 + 1 = 40
Масса гидроксида натрия равен:
Ответ: для полной нейтрализации 19,6 г серной кислоты необходимо 16 г гидроксида натрия.
Задача № 2. Определите объем водорода (н. у.), Который выделится при действии соляной кислоты на 13,5 г алюминия.
ν (H2) = 1,5 · ν (Al) = 1,5 · 0,5 моль = 0,75 моль
Объем газообразного водорода при нормальных условиях (н.у.) определяем по формуле: V = ν · Vm.
Объем водорода равна:
Ответ: при действии соляной кислоты на 13,5 г алюминия выделится 16,8 л водорода при нормальных условиях.
Урок по химии в 8-м классе по теме: "Генетическая связь между основными классами неорганических соединений"
Девиз урока:
« Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим».
Майкл Фарадей.
ЦЕЛЬ . На конкретных примерах доказать существование генетической связи между основными классами неорганических веществ.
Задачи:
Обучающие : систематизировать знания учащихся о составе и свойствах основных классов неорганических веществ.
Развивающие : развивать умения ставить проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; развивать предметные компетентности и способность к адекватному само- и взаимоконтролю.
Воспитательные : продолжить формирование научного мировоззрения обучающихся; воспитывать наблюдательность, внимание, инициативу.
Методы: проблемный, исследовательский, словесный.
Формы работы : групповая, индивидуальная работа,самопрверка, взаимопроверка результатов самостоятельной работы в группе, выставление отметок.
Оборудование : мультимедиапроектор, экран, презентация, штатив с пробирками, компетентностно-ориентированные задания.
Реактивы : натрий, вода, фенолфталеин, соляная кислота, оксид кальция, сульфат меди, гидроксид натрия.
Ход урока .
I.ОРГАНИЗАЦИОННО - МОТИВАЦИОННЫЙ ЭТАП
1.1 Оргмомент.
1.2 Актуализация знаний
Проводится эвристическая беседа с классом по пройденному материалу.
Какие вещества нас окружают в повседневной жизни? (Простые и сложные)
Какие простые вещества вам известны? (металлы и неметаллы)
Какие сложные вещества? (оксиды, основания, кислоты, соли) Что такое оксид? Какие бывают оксиды? Приведите примеры. Что такое кислота? Какие бывают кислоты? Приведите примеры. Что такое основание? Какие бывают основания? Примеры. Что такое соль? Каких солей мы знаем?
Постановка проблемы. Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Все в нем находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие. Все в нем взаимосвязано и взаимообусловлено. Это всеобщий закон природы.
Я предлагаю вам подтвердить или опровергнуть его.
Вам даны вещества: ВaO, P , NaCl, H 3 PO 4 , Вa(OH) 2 , Ca 3 (PO4) 2, , H 2 SO 4, ВаSO 4 , Вa, P 2 O 5 .
1. Из веществ, формулы которых предложены, выберите те, которые можно объединить в две группы.
Остановимся на том варианте, где учащиеся увидят формулы веществ, содержащих один и тот же элемент.
2. Попробуйте распределить их в два ряда по усложнению состава, начиная с простого вещества. Получили две цепи:
Ba BaO Ba(OH) 2 Ва SO 4
P P 2 O 5 H 3 PO 4 Ca 3 (PO 4 ) 2
Учитель: В каждой цепи есть общее - это химические элементы - Ba и P, они переходят от одного вещества к другому (как бы по наследству).
Учитель: Почему вы похожи на родителей, ваши родители на своих и т.д?
Ученик: Родственники обладают сходными признаками, которые передаются по наследству.
Вопрос: А что является носителем наследственной информации?
Ученик: Ген.
Учитель: Как вы думаете, какой элемент будет являться «геном» для данной цепи?
Ученик: Ва и Р
Учитель: Поэтому цепи или ряды называются генетическими.
Тема нашего урока: «Генетическая связь между основными классами неорганических соединений»
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca ( OH ) 2 → C а SO 4 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4 ) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Опыт №1 Na → NaOH → NaCL берем Na добавляем воду получаем гидроксид Na добавляем индикатор фенофталеин доказываем что это щелочь осторожно добавляем соляную кислоту. Происходить реакция нейтрализации. Раствор обесцвечивается, образуется соль и вода. Давайте напишем уравнения реакции.
Опыт №2 Инструкция1 .(Соблюдайте технику безопасности!)
1. В пробирку берем оксид кальция добавляем воду получаем гидроксид кальция Ca ( OH ) 2 добавляем индикатор фенофталеин осторожно добавьте серную кислоты. Что наблюдаете? Составьте уравнение химической реакции
CaO → Ca ( OH ) 2 → C а SO 4
Опыт №3 CuSO 4 → Cu ( OH ) 2 → CuO
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Обучающиеся выполняют задание « Найди родственников»
Задание « Найди родственников»
Из перечня формул составьте генетический ряд.
1 вариант : Ca(OH) 2 , CI 2, Ca, P, CaCO 3 , NaOH, CaO, CO 2.
2 вариант : AI , NaOH, AI(OH) 3 , CaO, CO 2 , AI 2 O 3 , P, AICI 3
3.2. ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ
Формулировка вывода:
Все в природе взаимосвязано, поэтому и в химии все вещества взаимосвязаны друг с другом и из одних можно получить другие .
3.3. ДОМАШНЕЕ ЗАДАНИЕ
Повторить тему: «Основные классы неорганических соединений» §, составить уравнения реакций к цепочкам, которые вы составили при выполнении задания «Найди родственников».
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов.
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т. е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
уже можно рассматривать как полный: он начинался простым веществом бромом и им же закончился.
Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетический ряд - это ряд веществ - представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь - понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный ряд веществ.
Существует три разновидности генетических рядов:
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления +2 и +3:

Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):

Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления +4 и +6:

Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
3. Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т. к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:

Генетическая связь между классами неорганических веществ
Характерными являются реакции между представителями разных генетических рядов. Вещества из одного генетического ряда, как правило, не вступают во взаимодействия.
Например:
1. металл + неметалл = соль
Hg + S = HgS
2Al + 3I 2 = 2AlI 3
2. основной оксид + кислотный оксид = соль
Li 2 O + CO 2 = Li 2 CO 3
CaO + SiO 2 =CaSiO 3
3. основание + кислота=соль
Cu(OH) 2 + 2HCl =CuCl 2 + 2H 2 O
FeCl 3 + 3HNO 3 = Fe(NO 3) 3 + 3HCl
соль кислота соль кислота
4. металл — основной оксид
2Ca + O 2 = 2CaO
4Li + O 2 =2Li 2 O
5. неметалл — кислотный оксид
S + O 2 = SO 2
4As + 5O 2 = 2As 2 O 5
6. основной оксид — основание
BaO + H 2 O = Ba(OH) 2
Li 2 O + H 2 O = 2LiOH
7. кислотный оксид — кислота
P 2 O 5 + 3H 2 O = 2H 3 PO 4
SO 3 + H 2 O =H 2 SO 4